|
Кислота
|
Химическая формула
|
Графическая формула
|
Молярная масса
|
Агрегатное состояние
|
Летучесть
|
Сила кислоты*
|
Основность кислоты
|
Растворимость в воде, г/100г при 20°С
|
|
Адипиновая
|
H10C6O4
|
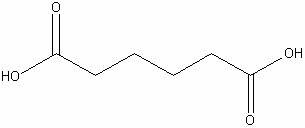 |
146,15
|
тв.
|
–
|
4,42
5,28
|
2
|
1,5
(при 15°С)
|
|
l-Аспаргиновая
|
H7С4O4N
|
133,12
|
тв.
|
–
|
3,90
10
|
2
|
0,5
|
|
|
d-Винная
|
H6C4O6
|
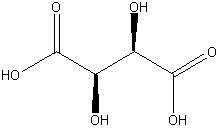 |
150,9
|
тв.
|
–
|
2,98
|
2
|
139
|
|
Гликолевая
|
H4C2O3
|
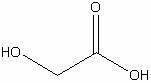 |
76,05
|
тв.
|
–
|
3,82
|
1
|
> 230
|
|
Лимонная
|
H8С6O7
|
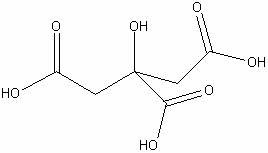 |
192,13
|
тв.
|
–
|
3,13
4,76
6,40
|
3
|
133
|
|
Малеиновая
|
H4C4O4
|
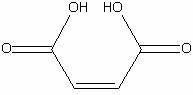 |
116,07
|
тв.
|
–
|
1,92
6,23
|
2
|
78,8
(при 25°С)
|
|
Малоновая
|
H4С3O4
|
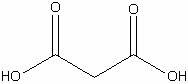 |
104,06
|
тв.
|
–
|
2,86
5,70
|
2
|
73,5
|
|
Метансульфоновая
|
CH4O3S
|
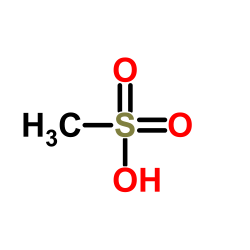 |
96,10
|
жид.
|
–
|
– 1,9
|
1
|
¥
|
|
Молочная
|
H6С3O3
|
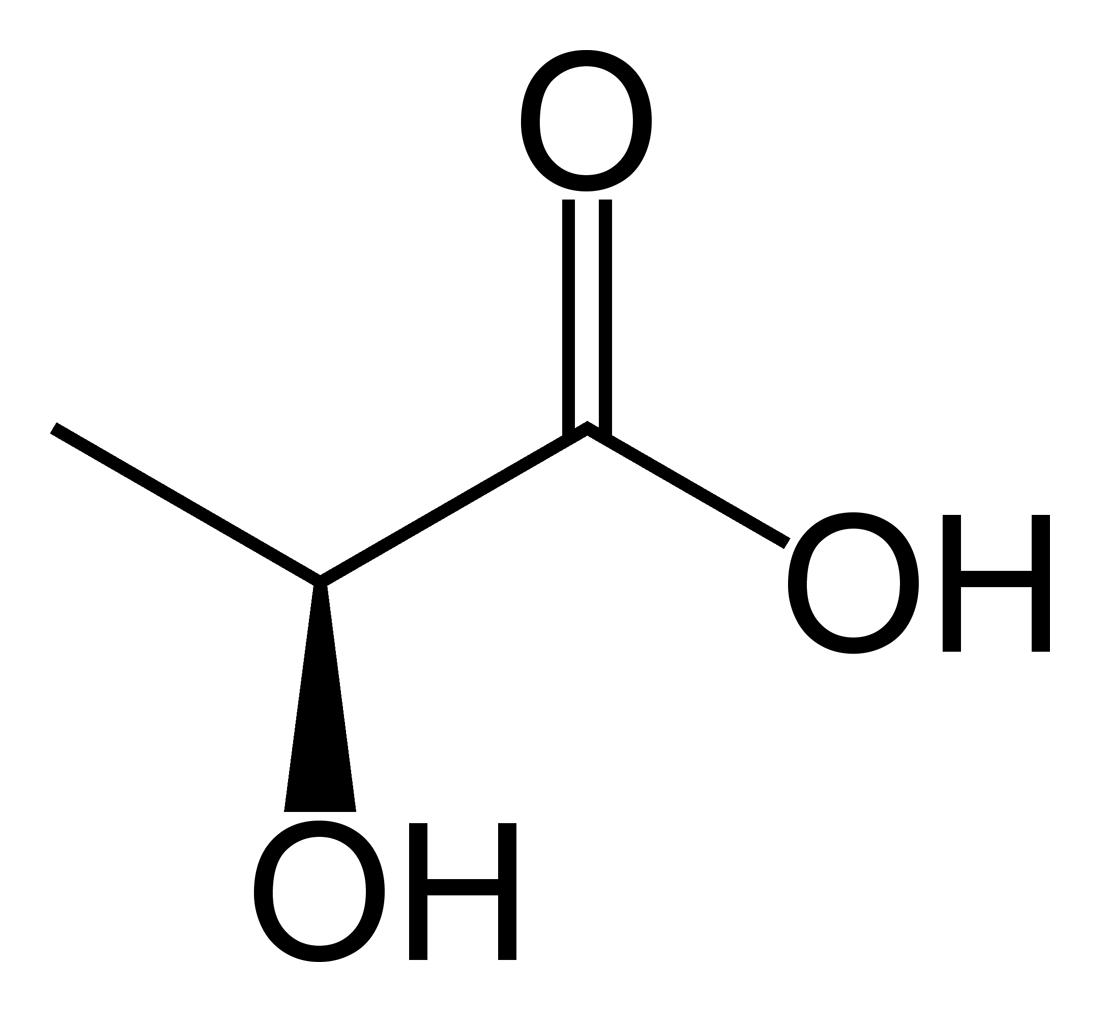 |
90,08
|
тв.
|
–
|
3,86
|
1
|
> 400
|
|
Муравьиная
|
H2CO2
|
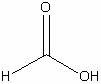 |
46,03
|
жид.
|
+
|
3,75
|
1
|
¥
|
|
Пропионовая
|
H6С3O2
|
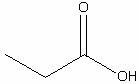 |
74,08
|
жид.
|
+
|
4,87
|
1
|
¥
|
|
Серная
|
H2SO4
|
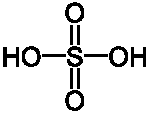 |
98,07
|
жид.
|
–
|
– 3
1,9
|
2
|
¥
|
|
Соляная
|
HCl
|
H–Cl
|
36,46
|
жид.
|
+
|
– 7
|
1
|
¥
|
|
Сульфаминовая
|
H3NO3S
|
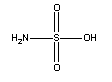 |
97,10
|
тв.
|
–
|
0,99
|
1
|
17,57
|
|
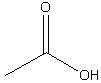
Уксусная
|
H4C2O2
|
 |
60,05
|
жид.
|
+
|
4,75
|
1
|
¥
|
|
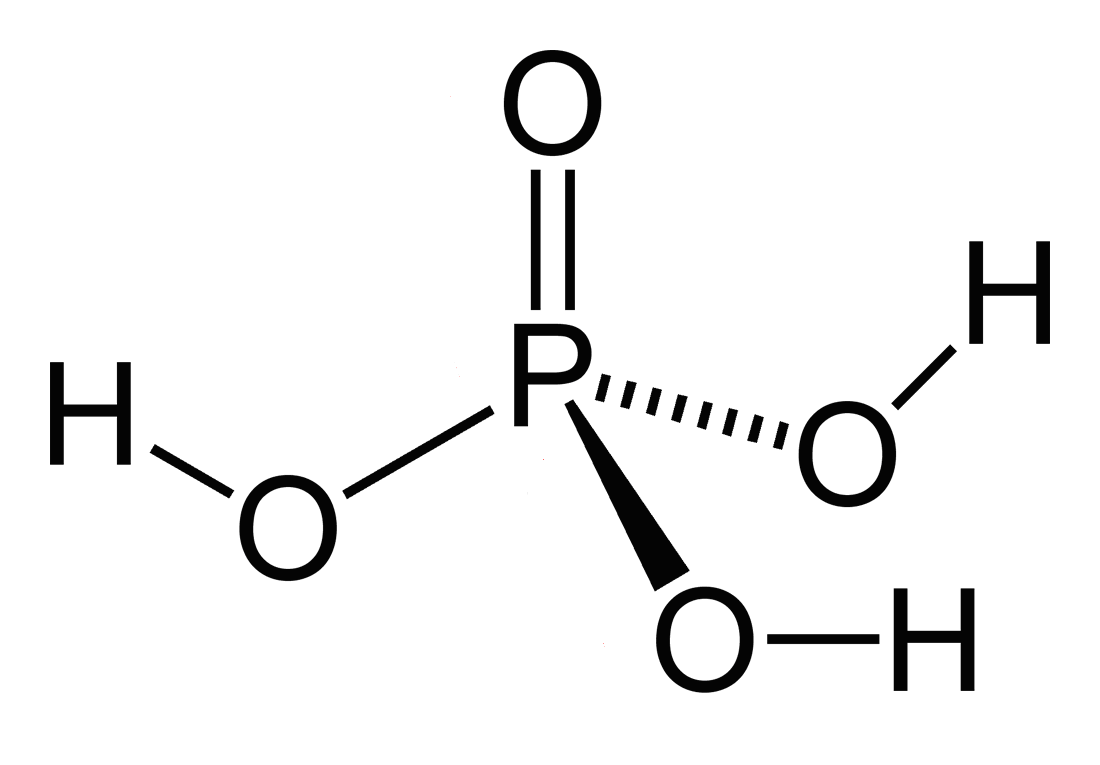
Фосфорная
|
H3PO4
|
 |
98,00
|
тв.
|
–
|
2,12
7,20
11,9
|
3
|
¥
|
|
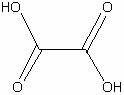
Щавелевая
|
H2C2O4
|
 |
90,04
|
тв.
|
–
|
1,27
4,27
|
2
|
10
|
|
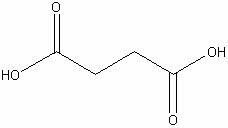
dl-Яблочная
|
H6С4O5
|
 |
134,09
|
тв.
|
–
|
3,40
5,11
|
2
|
144
(при 25°С)
|
|
Янтарная
|
H6C4O4
|
 |
118,09
|
тв.
|
–
|
4,21
5,64
|
2
|
6,8
|
|
Кислота
|
Количество протонов (H+), ммоль
|
|
Уксусная кислота
|
4
|
|
Муравьиная кислота
|
10
|
|
Лимонная кислота
|
50
|
|
Фосфорная кислота
|
80
|
|
Сульфаминовая кислота
|
270
|
|
Метансульфоновая кислота
|
1000
|
|
Соляная кислота
|
1000
|
|
Серная кислота
|
1095
|
© 2007-2024 БИО-ХИМ Все материалы защищены ст. 146 УК РФ.
Политика конфиденциальности
.
Политика обработки персональных данных
